يرجى استخدام متصفح الكمبيوتر الشخصي للوصول إلى التسجيل - تداول السعودية
أعلنت شركة Immuneering عن معدل بقاء استثنائي بنسبة 64% بعد 12 شهرًا لدى مرضى سرطان البنكرياس الذين يتلقون العلاج كخط أول باستخدام Atebimetinib + mGnP
Immuneering Corp. Class A IMRX | 4.63 | -4.93% |
- أظهرت نتائج المرحلة الثانية من التجارب السريرية أن معدل البقاء على قيد الحياة لمدة 12 شهرًا (OS) يقارب ضعف المعدل المرجعي للدراسة المحورية للعلاج القياسي باستخدام جيمسيتابين/ناب-باكليتاكسيل (GnP) -
- يُظهر أتيبيميتينيب باستمرار ميزة بقاء إجمالية رائعة في جميع الفترات الزمنية المبلغ عنها؛ ولا يزال متوسط البقاء الإجمالي غير مُحقق حتى تاريخ قطع البيانات، مما يشير إلى استمرارية مُشجعة للفائدة السريرية.
- من المتوقع إعطاء الجرعة لأول مريض في المرحلة الثالثة من التجربة السريرية المحورية، MAPKeeper 301، في منتصف عام 2026 -
- ستعقد الشركة مؤتمراً عبر الهاتف في تمام الساعة 4:30 مساءً بتوقيت شرق الولايات المتحدة اليوم -
نيويورك، 7 يناير 2026 (جلوب نيوزواير) - أعلنت شركة إيميونيرينغ (ناسداك: IMRX)، وهي شركة متخصصة في علم الأورام السريري في المراحل المتأخرة وتركز على إبقاء مرضى السرطان على قيد الحياة ومساعدتهم على الازدهار، اليوم عن بيانات إيجابية محدثة عن البقاء على قيد الحياة بشكل عام (OS) والسلامة من تجربتها الجارية من المرحلة 2a لعقار أتيبيميتينيب (IMM-1-104) بالاشتراك مع جيمسيتابين/ناب-باكليتاكسيل المعدل (mGnP) في مرضى سرطان البنكرياس في الخط الأول (N=34)، مع متوسط فترة متابعة تزيد عن 13 شهرًا.
أعرب الدكتور بن زيسكيند، الرئيس التنفيذي لشركة إيميونيرينغ، عن سعادته قائلاً: "يسرّنا الإعلان عن تحقيق نسبة بقاء إجمالية بلغت 64% بعد 12 شهرًا لدى مرضى سرطان البنكرياس الذين يتلقون العلاج الأولي باستخدام أتيبيميتينيب مع mGnP. وقد حافظت النتائج على التباين الكبير في نسبة البقاء الإجمالية بين تجربتنا السريرية لأتيبيميتينيب مع mGnP لدى مرضى سرطان البنكرياس الذين يتلقون العلاج الأولي، وبين معيار الرعاية القياسي GnP من دراسة MPACT، وذلك عند 6 أشهر و9 أشهر و12 شهرًا. وبعد أن توصلنا مؤخرًا إلى اتفاق مع إدارة الغذاء والدواء الأمريكية (FDA) ووكالة الأدوية الأوروبية (EMA) بشأن تصميم تجربتنا السريرية المحورية من المرحلة الثالثة، والتي تُعتبر فيها نسبة البقاء الإجمالية هي الهدف الرئيسي، نعتزم إعطاء الجرعة الأولى لأول مريض في تجربتنا المحورية MAPKeeper 301 في منتصف عام 2026، سعيًا منا لتوفير هذا الخيار العلاجي الجديد للمرضى بأسرع وقت ممكن."
لوحظت معدلات بقاء إجمالية استثنائية (OS) بعد 12 شهرًا في علاج سرطان البنكرياس كخط علاج أول

لأغراض التوضيح فقط: لم تُجرَ أي تجربة سريرية مباشرة لتقييم أتيبيميتينيب مع مرشحين أو منتجات أخرى. توجد اختلافات بين تصميمات التجارب وخصائص المشاركين وعوامل أخرى، لذا يجب توخي الحذر عند مقارنة البيانات بين الدراسات. مخطط كابلان-ماير المُعاد بناؤه للدراسة المحورية من المرحلة الثالثة MPACT 2013 NEJM (PMID: 24131140) وفقًا لـ JAMA 2024 Nichetti، وآخرون. 7(1):e2350756
- لوحظ تباين قوي ومستمر في معدل البقاء على قيد الحياة الإجمالي مقارنةً بالعلاج القياسي. أظهر العلاج المركب من أتيبيميتينيب (بجرعة 320 ملغ مرة واحدة يوميًا) مع mGnP تحسنًا ملحوظًا في معدل البقاء على قيد الحياة الإجمالي بعد 12 شهرًا (متوسط فترة المتابعة 13.4 شهرًا) لدى مرضى سرطان البنكرياس الذين يتلقون العلاج كخط أول (ن=34)، مع العلم أن متوسط البقاء على قيد الحياة الإجمالي لم يُحدد بعد حتى تاريخ قطع البيانات في 15 ديسمبر 2025. في المقابل، أظهرت التجربة المحورية MPACT، التي اعتمدت على العلاج القياسي جيمسيتابين/ناب-باكليتاكسيل، انخفاضًا ملحوظًا في معدل البقاء على قيد الحياة الإجمالي، كما هو موضح أدناه.
- لوحظت نسبة بقاء إجمالية قدرها 64% عند 12 شهرًا؛ بينما أفاد معيار الرعاية القياسي بنسبة بقاء إجمالية قدرها 35% عند 12 شهرًا.
- لوحظت نسبة بقاء إجمالية قدرها 83% عند 9 أشهر؛ بينما أفاد المعيار المرجعي للرعاية بنسبة بقاء إجمالية تبلغ حوالي 47% عند 9 أشهر.
- لوحظت نسبة بقاء إجمالية قدرها 94% عند 6 أشهر؛ بينما أفاد المعيار المرجعي للرعاية بنسبة بقاء إجمالية قدرها 67% عند 6 أشهر.
- لوحظ أيضاً انفصال قوي في نقاط النهاية البديلة عن معيار الرعاية.
- تم تأكيد معدل الاستجابة الكلي (ORR) بنسبة 39٪ عند 12 شهرًا؛ بينما أبلغ معيار الرعاية القياسي عن معدل استجابة كلي بنسبة 23٪.
- معدل السيطرة على المرض (DCR) بنسبة 81٪ عند 12 شهرًا؛ وقد أبلغ معيار الرعاية القياسي عن معدل سيطرة على المرض بنسبة 48٪.
- متوسط البقاء على قيد الحياة الخالي من تطور المرض (mPFS) هو 8.5 أشهر؛ بينما أفاد معيار الرعاية القياسي أن متوسط البقاء على قيد الحياة الخالي من تطور المرض هو 5.5 أشهر.
ما لم يُنص على خلاف ذلك، تُعرض جميع البيانات باستخدام تاريخ قطع البيانات في 15 ديسمبر 2025، من نفس مجموعة المرضى (عددها 34) التي سبق الإبلاغ عنها في سبتمبر 2025. وقد تم الإبلاغ عن تقديرات (وغيرها من المراجع) معيار الرعاية المذكور أعلاه فيما يتعلق ببيانات المتابعة لمدة 6 و12 شهرًا مباشرةً من بيانات التجربة المحورية MPACT المتاحة للجمهور من طرف ثالث لعقار جيمسيتابين/ناب-باكليتاكسيل. أما تقديرات (وغيرها من المراجع) معيار الرعاية فيما يتعلق ببيانات المتابعة لمدة تسعة أشهر، فقد تم استقراءها وإعادة بنائها من قبل الشركة استنادًا إلى بيانات التجربة المحورية MPACT المتاحة للجمهور من طرف ثالث لعقار جيمسيتابين/ناب-باكليتاكسيل. ولا تتضمن التجربة السريرية للمرحلة 1/2أ التي تجريها الشركة على عقار أتيبيميتينيب مقارنة مباشرة مع أي عوامل أخرى، لذا يجب توخي الحذر عند مقارنة البيانات بين التجارب.
وتعتقد الشركة أن بيانات البقاء على قيد الحياة المحدثة والمقنعة هذه تعكس إمكانية تحقيق فائدة مستدامة ومتراكمة مع استخدام أتيبيميتينيب + mGnP في علاج مرضى سرطان البنكرياس في الخط الأول.
استمرار ملاحظة مستوى تحمل جيد
حتى تاريخ قطع البيانات في 15 ديسمبر 2025، استمر دواء أتيبيميتينيب (بجرعة 320 ملغ مرة واحدة يوميًا) مع mGnP في إظهار تحمل جيد لدى مرضى سرطان البنكرياس الذين يتلقون العلاج كخط أول (ن=34)، حيث لوحظت فئتان فقط من الآثار الجانبية من الدرجة الثالثة لدى أكثر من 10% من المرضى (قلة العدلات وفقر الدم، وهما فئتان شائعتان في العلاج الكيميائي القياسي، وقد ذُكرتا سابقًا في تحديث سبتمبر 2025). لم يتم رصد أي مؤشرات سلامة جديدة.
استمرار مستوى التحمل الجيد في علاج سرطان البنكرياس كخط علاج أول
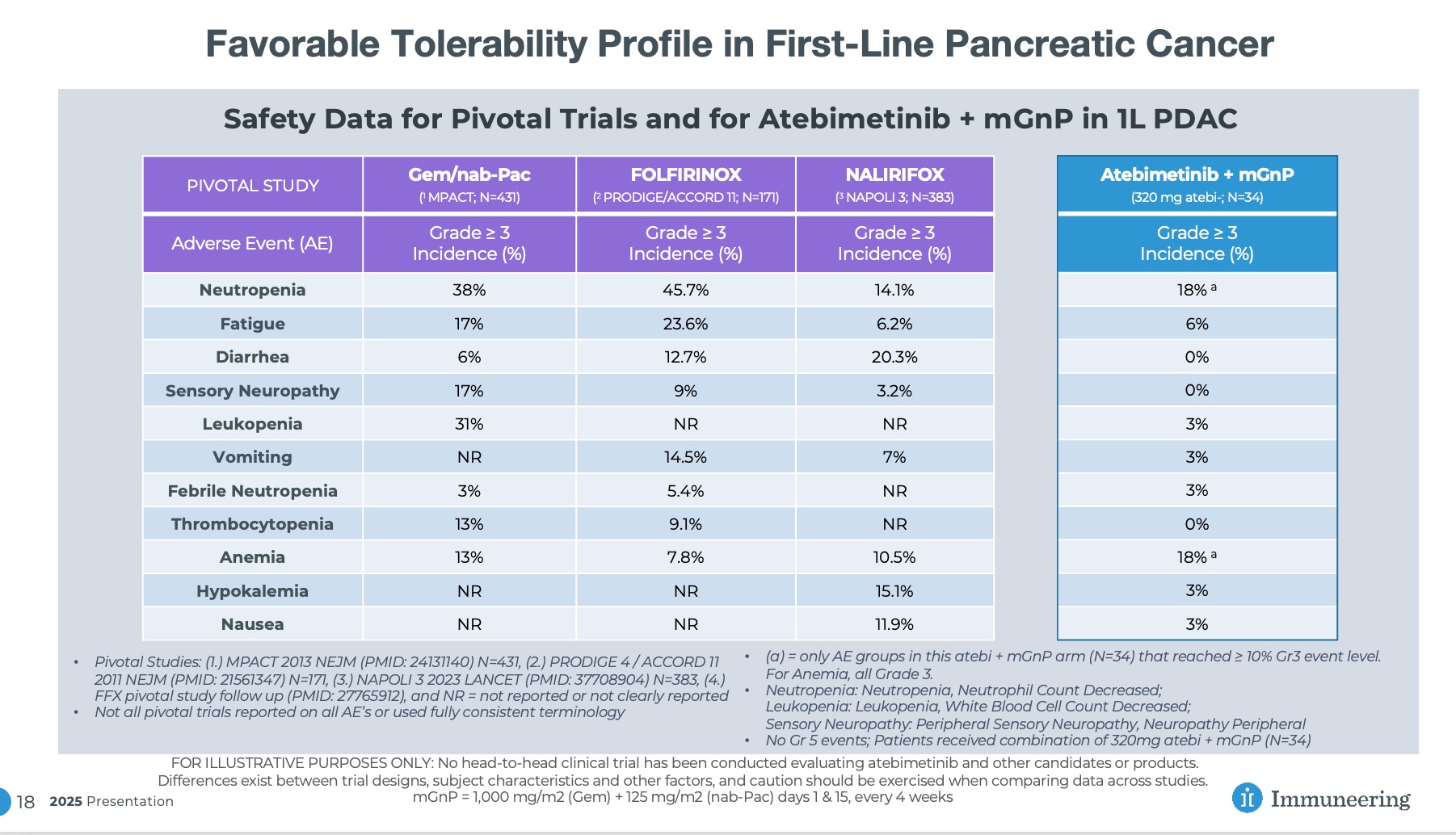
لأغراض التوضيح فقط: لم تُجرَ أي تجربة سريرية مباشرة لتقييم أتيبيميتينيب مع مرشحين أو منتجات أخرى. توجد اختلافات بين تصميمات التجارب وخصائص المشاركين وعوامل أخرى، لذا يجب توخي الحذر عند مقارنة البيانات بين الدراسات. mGnP = 1000 ملغم/م² (جيمسيتابين) + 125 ملغم/م² (ناب-باكليتاكسيل) في اليومين 1 و15، كل 4 أسابيع
"استنادًا إلى البيانات الاستثنائية من المرحلة الثانية (أ) من التجارب السريرية الجارية لعقار أتيبيميتينيب مع mGnP كعلاج أولي لسرطان البنكرياس، نعتقد أن أتيبيميتينيب يمتلك القدرة على تحقيق معدلات بقاء إجمالية استثنائية مع استدامة وتحمل جيد، وهما عنصران أساسيان يركزان على المريض، لطالما سعى أطباء الأورام إلى تحقيق التوازن بينهما"، صرّح إيغور ماتوشانسكي، كبير المسؤولين الطبيين في شركة إيميونيرينغ. "في النصف الأول من عام 2026، نعتزم تقديم تحديث حول مجموعة موسعة تضم أكثر من 50 مريضًا مصابًا بسرطان البنكرياس كعلاج أولي، تشمل المرضى الـ 34 الأصليين، بالإضافة إلى مرضى آخرين كنا قد أعلنا سابقًا عن نيتنا إشراكهم، والذين يقتربون من استكمال فترة المتابعة المتوسطة الكافية لعرض نتائجهم. يسرّنا أن نرى أن معدلات البقاء الإجمالية في المجموعة الموسعة تتوافق مع ما أبلغنا عنه في المرضى الـ 34 الأصليين."
"تُظهر بيانات البقاء على قيد الحياة الإجمالية المُبلغ عنها لعقار أتيبيميتينيب إمكانية أن يكون خيارًا علاجيًا أفضل لمرضى سرطان البنكرياس، الذين هم في أمسّ الحاجة إلى علاجات أكثر فعالية وأسهل تحملاً"، هذا ما قالته الدكتورة ميريديث بيلستر، المديرة المساعدة لأبحاث سرطان الجهاز الهضمي في معهد سارة كانون للأبحاث، والباحثة الرئيسية في المرحلة الثانية من التجارب السريرية. وأضافت: "أتطلع إلى المستقبل، وأشارك الكثيرين في هذا المجال حماسهم للتجربة السريرية المحورية المخطط لها للمرحلة الثالثة من أتيبيميتينيب، وأتطلع إلى تسجيل المرضى في البرنامج".
توقعات الإنجازات الرئيسية على المدى القريب
تخطط شركة Immuneering لتحقيق العديد من الإنجازات المتوقعة على المدى القريب والمتعلقة بدواء أتيبيميتينيب، بما في ذلك:
- الربع الثاني من عام 2026: تقديم تقرير محدث عن بيانات الحمض النووي للأورام المنتشرة حول التغيرات المكتسبة في اجتماع علمي رئيسي.
- النصف الأول من عام 2026: الإبلاغ عن بيانات البقاء على قيد الحياة المحدثة لأكثر من 50 مريضًا مصابًا بسرطان البنكرياس في الخط الأول والذين عولجوا باستخدام أتيبيميتينيب + mGnP.
- منتصف عام 2026: إعطاء الجرعة الأولى للمريض في المرحلة الثالثة من التجارب السريرية المحورية لعقار أتيبيميتينيب بالاشتراك مع mGnP في علاج سرطان البنكرياس كخط علاج أول.
- النصف الثاني من عام 2026: إعطاء الجرعة الأولى للمريض في تجربة أتيبيميتينيب بالاشتراك مع ليبتايو في سرطان الرئة ذي الخلايا غير الصغيرة.
مكالمة جماعية
ستعقد شركة إيميونيرينغ مؤتمراً عبر الهاتف وبثاً مباشراً عبر الإنترنت في تمام الساعة 4:30 مساءً بتوقيت شرق الولايات المتحدة / 1:30 مساءً بتوقيت المحيط الهادئ يوم 7 يناير 2026، لمناقشة البيانات وتقديم آخر المستجدات المتعلقة بأعمال الشركة. يمكن للأفراد الراغبين في الاستماع إلى المؤتمر عبر الهاتف الاتصال بالرقم (800) 715-9871 للمتصلين من الولايات المتحدة، أو (646) 307-1963 للمتصلين من خارج الولايات المتحدة، مع ذكر رمز المؤتمر 8438896، أو من خلال رابط البث المباشر الموجود في قسم "المستثمرون" على موقع الشركة الإلكتروني www.immuneering.com . سيكون تسجيل البث المباشر متاحاً في قسم علاقات المستثمرين على موقع الشركة الإلكتروني لمدة 90 يوماً بعد انتهاء المؤتمر.
نبذة عن أتيبيميتينيب
أتيبيميتينيب هو مثبط حلقي عميق (DCI)، وهو نموذج جديد في العلاج الموجه. تتحدى مثبطات DCI النموذج التقليدي للتثبيط المستمر في علم الأورام. فبينما تُصمم معظم العلاجات للتثبيط المستمر، مما يدفع السرطان إلى التكيف وتطوير مقاومة، وبالتالي ينكمش الورم بسرعة ولكن بشكل مؤقت، تُصمم مثبطات DCI لتُطلق نبضات أسرع من قدرة الورم على التكيف، مما يؤدي إلى انكماش الورم ببطء ولكن بشكل دائم. علاوة على ذلك، تهدف مثبطات DCI إلى استعادة الإشارات العابرة الكاملة للخلايا السليمة، بهدف تقليل الآثار الجانبية. يستهدف أتيبيميتينيب MEK، وهي نقطة تحكم رئيسية في مسار MAPK (RAS-RAF-MEK-ERK)، الذي يُنشط بشكل مرضي في غالبية أنواع السرطان، بما في ذلك حوالي 97% من سرطانات البنكرياس. استهداف MEK يمنع نطاقًا أوسع من التغيرات في مسار MAPK لأنه يقع في مرحلة لاحقة، مما يخلق إمكانية لتحقيق فائدة أكثر استدامة.
نبذة عن شركة المناعة
شركة إيمونييرينغ هي شركة متخصصة في علم الأورام السريري في مراحله المتقدمة، وتركز على إنقاذ حياة مرضى السرطان ومساعدتهم على التعافي. تعمل الشركة على تطوير فئة جديدة كليًا من أدوية السرطان، وهي مثبطات مسار MAPK الحلقية العميقة. يُعدّ أتيبيميتينيب، المنتج الرئيسي للشركة، مثبطًا فمويًا يُؤخذ مرة واحدة يوميًا لمسار MAPK الحلقي العميق، وهو مصمم لتحسين فعالية الدواء وتحمله في العديد من أنواع السرطان، بما في ذلك الأورام التي يحركها مسار MAPK مثل سرطان البنكرياس. من المقرر حاليًا تقييم أتيبيميتينيب في تجربة سريرية من المرحلة الثالثة كخط علاج أول لسرطان البنكرياس، ومن المتوقع أن تبدأ الجرعات في منتصف عام 2026. كما تتضمن خطة تطوير الشركة برامج في مراحلها المبكرة. لمزيد من المعلومات، يُرجى زيارة الموقع الإلكتروني www.immuneering.com .
البيانات التطلعية
يحتوي هذا البيان الصحفي على بيانات تطلعية، بما في ذلك البيانات الواردة في قانون إصلاح التقاضي بشأن الأوراق المالية الخاصة لعام 1995. يجب اعتبار جميع البيانات الواردة في هذا البيان الصحفي والتي لا تتعلق بوقائع تاريخية بيانات تطلعية، بما في ذلك، على سبيل المثال لا الحصر، البيانات المتعلقة بما يلي: الإمكانات العلاجية لعقار أتيبيميتينيب، سواءً بمفرده أو بالاشتراك مع عوامل أخرى لعلاج السرطان، بما في ذلك جيمسيتابين/ناب-باكليتاكسيل المعدل (mGnP) في الخط الأول لعلاج سرطان البنكرياس، بما في ذلك قدرته على تحقيق معدلات بقاء إجمالية استثنائية مع كل من الاستدامة والتحمل؛ وتوقيت بدء الجرعات في المرحلة الثالثة من التجارب السريرية؛ وقدرة أتيبيميتينيب + mGnP على تحقيق فائدة أكثر استدامة وتراكمية، بما في ذلك مقارنةً بالمعيار العلاجي المعتمد؛ وتوقيت ومكان ومحتوى إصدارات البيانات والعروض التقديمية المستقبلية، واستمرار الاتجاه الإيجابي لنتائج المرحلة الثانية؛ وتوقيت بدء أذرع التجارب السريرية الإضافية لعقار أتيبيميتينيب، بما في ذلك في سرطان الرئة ذي الخلايا غير الصغيرة.
تستند هذه البيانات التطلعية إلى توقعات الإدارة الحالية. ولا تُعدّ هذه البيانات وعودًا أو ضمانات، بل تنطوي على مخاطر معروفة وغير معروفة، وشكوك، وعوامل أخرى مهمة قد تؤدي إلى اختلاف نتائجنا أو أدائنا أو إنجازاتنا الفعلية اختلافًا جوهريًا عن أي نتائج أو أداء أو إنجازات مستقبلية صريحة أو ضمنية في البيانات التطلعية، بما في ذلك، على سبيل المثال لا الحصر، ما يلي: المخاطر الكامنة في أبحاث وتطوير أدوية الأورام، بما في ذلك اكتشاف الهدف، والتحقق من صحة الهدف، وتحديد المركب الرائد، وتحسين المركب الرائد؛ لقد تكبدنا خسائر كبيرة، ونحن لسنا مربحين حاليًا، وقد لا نصبح مربحين أبدًا؛ المدة المتوقعة لتدفقاتنا النقدية؛ حاجتنا إلى تمويل إضافي؛ نهجنا غير المثبت في التدخل العلاجي؛ قدرتنا على معالجة المسائل التنظيمية والشكوك المتعلقة بالملفات التنظيمية والمراجعات والموافقات؛ عملية تطوير الأدوية السريرية الطويلة والمكلفة وغير المؤكدة، بما في ذلك التأخيرات المحتملة في الحصول على الموافقات التنظيمية أو عدم الحصول عليها؛ اعتمادنا على أطراف ثالثة ومتعاونين لإجراء تجاربنا السريرية، وتصنيع منتجاتنا المرشحة، وتطويرها وتسويقها، في حال الموافقة عليها؛ عدم القدرة على المنافسة بنجاح مع شركات الأدوية الأخرى؛ حماية تقنيتنا الخاصة وسرية أسرارنا التجارية؛ الدعاوى القضائية المحتملة أو المطالبات المتعلقة بانتهاك الملكية الفكرية للطرف الثالث أو الطعون في ملكية ملكيتنا الفكرية؛ اعتبار براءات اختراعنا غير صالحة أو غير قابلة للتنفيذ؛ تكاليف وموارد العمل كشركة عامة؛ وعدم وجود أبحاث أو تقارير تحليلية مواتية أو معدومة.
قد تؤدي هذه العوامل، وغيرها من العوامل المهمة التي نوقشت تحت عنوان "عوامل الخطر" في تقريرنا الفصلي على النموذج 10-Q للفترة المنتهية في 30 سبتمبر 2025، وتقاريرنا الأخرى المقدمة إلى هيئة الأوراق المالية والبورصات الأمريكية، إلى اختلاف النتائج الفعلية اختلافًا جوهريًا عن تلك المشار إليها في البيانات التطلعية الواردة في هذا البيان الصحفي. وتمثل هذه البيانات التطلعية تقديرات الإدارة اعتبارًا من تاريخ هذا البيان الصحفي. وبينما قد نختار تحديث هذه البيانات التطلعية في وقت لاحق، فإننا نخلي مسؤوليتنا عن أي التزام بالقيام بذلك، باستثناء ما يقتضيه القانون، حتى لو أدت أحداث لاحقة إلى تغيير وجهات نظرنا. ولا ينبغي الاعتماد على هذه البيانات التطلعية باعتبارها تمثل وجهات نظرنا في أي تاريخ لاحق لتاريخ هذا البيان الصحفي.
للتواصل الإعلامي:
كارسون كريان
202-878-8330
Carson.creehan@padillaco.com
للتواصل مع المستثمرين:
كورتني دوجان
917-971-3466
Cdugan@immuneering.com
لورانس واتس
619-916-7620
laurence@newstreetir.com
تتوفر الصور المصاحبة لهذا الإعلان على الرابط التالي:
https://www.globenewswire.com/NewsRoom/AttachmentNg/1168a985-0b95-416c-a580-d80bb6584779
https://www.globenewswire.com/NewsRoom/AttachmentNg/efce47fa-ef41-4495-a396-8e1e2bf09daf



